
Kõik iLive'i sisu vaadatakse meditsiiniliselt läbi või seda kontrollitakse, et tagada võimalikult suur faktiline täpsus.
Meil on ranged allhanke juhised ja link ainult mainekate meediakanalite, akadeemiliste teadusasutuste ja võimaluse korral meditsiiniliselt vastastikuste eksperthinnangutega. Pange tähele, et sulgudes ([1], [2] jne) olevad numbrid on nende uuringute linkideks.
Kui tunnete, et mõni meie sisu on ebatäpne, aegunud või muul viisil küsitav, valige see ja vajutage Ctrl + Enter.
Pimesoolepõletik
Artikli meditsiiniline ekspert
Viimati vaadatud: 12.07.2025
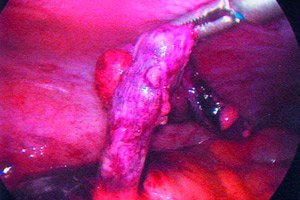
Apenditsiit on pimesoole äge põletik, mida tavaliselt iseloomustavad kõhuvalu, isutus ja kõhu hellus.
Diagnoos pannakse kliiniliselt, sageli täiendatakse seda kompuutertomograafia või ultraheliga. [ 1 ]
Apenditsiidi ravi hõlmab pimesoole kirurgilist eemaldamist. [ 2 ], [ 3 ]
Pimesoole anatoomia
Pimesoole ametlik nimetus on "Appendix Vermiformis". Pimesool on tõeline divertikulum, mis tekib pimesoole posteromediaalsest servast ja asub ileotsekaalse klapi lähedal. Pimesoole alust saab usaldusväärselt leida taeniae coli koondumiskoha lähedal pimesoole tipus. Mõiste "vermiformis" on ladina keeles "ussikujuline" [ 4 ] ja seda seletatakse selle pika torukujulise arhitektuuriga. Erinevalt omandatud divertikulum'ist on see tõeline käärsoole divertikulum, mis sisaldab kõiki käärsoole kihte: limaskesta, submukoosat, pikisuunalist ja ringikujulist lihaskatet ning serooskesta. Käärsoole ja pimesoole histoloogiline erinevus sõltub B- ja T-lümfoidrakkude olemasolust pimesoole limaskestas ja submukoosas. [ 5 ]
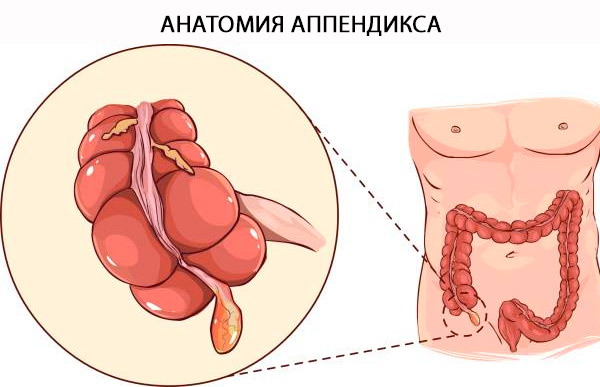
Struktuur ja funktsioonid
Pimesoole pikkus võib varieeruda 5–35 cm, keskmiselt 9 cm. [ 6 ] Pimesoole funktsioon on traditsiooniliselt olnud vaidluste objekt. Limaskesta neuroendokriinsed rakud toodavad amiine ja hormoone, mis aitavad läbi viia mitmesuguseid bioloogilisi kontrollmehhanisme, samas kui lümfoidkude osaleb B-lümfotsüütide küpsemises ja IgA antikehade tootmises. Selle funktsiooni kohta inimestel puuduvad selged tõendid. Soolestikuga seotud lümfoidkoe olemasolu lamina proprias on viinud arvamuseni, et sellel on immuunfunktsioon, kuigi selle täpset olemust pole kunagi kindlaks tehtud. Selle tulemusena on elund suures osas säilitanud oma maine vestigiaalse organina. Kuna aga sooleimmuunsuse mõistmine on viimastel aastatel paranenud, on tekkinud teooria, et pimesool on sümbiootiliste soolemikroobide "pühamu". [ 7 ] Tõsised kõhulahtisuse episoodid, mis võivad soolestiku kommensaalsetest bakteritest puhastada, võivad olla asendatud pimesooles sisalduvate ravimitega. See viitab evolutsioonilisele eelisele pimesoole säilitamisel ja nõrgestab teooriat, et elund on vestigiaalne. [ 8 ]
Füsioloogilised variandid
Kuigi pimesoole ava asukoht pimesoole põhjas on stabiilne anatoomiline tunnus, ei ole selle tipu asend seda. Asendi variatsioonide hulka kuuluvad retrotsekaalne (kuid intraperitoneaalne), subtsekaalne, pre- ja postileaalne, vaagna ja kuni hepatorenaalse taskuni. Lisaks võivad pimesoole asendit mõjutada sellised tegurid nagu rüht, hingamine ja külgneva soole laienemine. Retrotsekaalne asend on kõige levinum. See võib pimesoolepõletiku diagnoosimisel kliinilist segadust tekitada, kuna asendi muutused võivad põhjustada erinevaid sümptomeid. Pimesoole ageneesi, samuti duplikatsiooni või triplikatsiooni, kirjeldatakse kirjanduses harva. Raseduse edenedes nihutab suurenev emakas pimesoole kraniaalselt, nii et kolmanda trimestri lõpuks võib paremas ülakvadrandis tunda pimesoolepõletikuga seotud valu.
Kliiniline tähtsus
Ägeda pimesoolepõletiku patogenees sarnaneb teiste õõnsate viskoossete organite omaga ja arvatakse, et selle kõige sagedamini põhjustab obstruktsioon. Sapikivi või mõnikord sapikivi, kasvaja või uss sulgeb pimesoole ava, põhjustades suurenenud luminaalset rõhku ja häiritud venoosset väljavoolu. Noortel täiskasvanutel on obstruktsioon sagedamini tingitud lümfoidse hüperplaasiast. Pimesool saab verevarustuse pimesoolearterist, mis on lõpparter. Kuna luminaalne rõhk ületab perfusioonirõhu, tekib isheemiline kahjustus, mis soodustab bakterite vohamist ja põhjustab põletikulist reaktsiooni. See nõuab erakorralist kirurgilist abi, kuna põletikulise pimesoole perforatsioon võib põhjustada bakteriaalse sisu lekkimist kõhukelmeõõnde.[ 9 ]
Kui pimesoole sein põletikuliseks muutub, stimuleeritakse vistseraalseid aferentseid kiude. Need kiud sisenevad seljaaju T8-T10-s, põhjustades klassikalist difuusset periumbilikaalset valu ja iiveldust, mida iseloomustab varajane pimesoolepõletik. Põletiku progresseerudes ärritub parietaalne kõhukelme, stimuleerides somaatilisi närvikiude ja põhjustades lokaliseeruvamat valu. Asukoht sõltub pimesoole tipu asendist. Näiteks retrotsekaalne pimesool võib põhjustada valu paremal küljel. Patsiendi parema puusa sirutamine võib seda valu põhjustada. Valu, mis tekib niude-nimmelihase venitamisel puusa sirutamisel vasakule külgmisele lamamisasendile, on tuntud kui "psoase märk". Teine klassikaline ägeda pimesoolepõletiku tunnus on McBurney märk. See tekib kõhuseina palpeerimisel McBurney punktis (kaks kolmandikku kaugusest nabast parema eesmise ülemise niudeluulülini), kui tekib valu. Kahjuks ei ole need tunnused ja sümptomid alati esinevad, mistõttu on kliiniline diagnoosimine keeruline. Kliiniline pilt hõlmab sageli iiveldust, oksendamist, madalat palavikku ja veidi kõrgenenud leukotsüütide arvu.
Epidemioloogia
Äge kõhuvalu moodustab 7–10% kõigist erakorralise meditsiini osakonna külastustest.[ 10 ] Äge pimesoolepõletik on üks levinumaid alakõhuvalu põhjuseid, mille tõttu patsiendid pöörduvad erakorralise meditsiini osakonda, ning see on kõige levinum diagnoos, mis pannakse ägeda kõhuvaluga haiglasse hospitaliseeritud noortele patsientidele.
Ägeda pimesoolepõletiku esinemissagedus on alates 1940. aastate lõpust pidevalt vähenenud. Arenenud riikides esineb äge pimesoolepõletik 5,7–50 patsiendil 100 000 elaniku kohta aastas, kusjuures esinemissagedus on kõige suurem 10–30-aastastel lastel.[ 11 ],[ 12 ]
On teatatud geograafilistest erinevustest, kusjuures ägeda pimesoolepõletiku tekkimise risk elu jooksul on Ameerika Ühendriikides 9%, Euroopas 8% ja Aafrikas 2%.[ 13 ] Lisaks on ägeda pimesoolepõletikuga patsientide puhul suuri erinevusi haiguse esinemises, raskusastmes, radioloogilises uuringus ja kirurgilises ravis, mis on seotud riigi sissetulekuga.[ 14 ]
Perforatsioonide esinemissagedus varieerub 16%-st 40%-ni, kusjuures suurem esinemissagedus esineb nooremates vanuserühmades (40–57%) ja üle 50-aastastel patsientidel (55–70%).[ 15 ]
Mõned autorid teatavad soolisest eelsoodumusest igas vanuses, meeste seas veidi kõrgemast, kusjuures elu jooksul on esinemissagedus meestel 8,6% ja naistel 6,7%.[ 16 ] Naistel on aga pimesooleoperatsioonide määr suurem mitmesuguste pimesoolepõletikku meenutavate günekoloogiliste haiguste tõttu.[ 17 ]
Rahvastikupõhise etnilise statistika kohaselt on pimesoolepõletik sagedasem valgete, mitte-hispaanlaste ja hispaanlaste rühmades ning harvem mustanahaliste ja teiste rassilis-etniliste rühmade seas.[ 18 ] Andmed näitavad aga, et vähemusrühmadel on suurem perforatsiooni ja tüsistuste risk.[ 19 ],[ 20 ]
Põhjused pimesoolepõletik
Arvatakse, et pimesoolepõletik tekib pimesoole valendiku ummistuse tõttu, tavaliselt lümfoidkoe hüperplaasia tagajärjel, kuid mõnikord ka väljaheitekivide, võõrkehade või isegi helmintide tõttu. Obstruktsioon viib pimesoole laienemiseni, infektsiooni kiire arenguni, isheemiani ja põletikuni.
Ravimata jätmise korral tekivad nekroos, gangreen ja perforatsioon. Kui perforatsioon on kaetud rasvkesega, tekib pimesoole abstsess.
Ameerika Ühendriikides on äge pimesoolepõletik kõige levinum ägeda kõhuvalu põhjus, mis vajab kirurgilist ravi.
Pimesoole kasvajad, näiteks kartsinoidkasvajad, pimesoole adenokartsinoom, sooleparasiidid ja hüpertroofiline lümfikude, on pimesoole obstruktsiooni ja pimesoolepõletiku teadaolevad põhjused. Pimesool võib olla kahjustatud ka Crohni tõve või haavandilise koliidi ja pankoliidi korral.
Üks populaarsemaid väärarusaamu on Harry Houdini surmalugu. Pärast ootamatut lööki kõhtu levivad kuuldused, et tema pimesool rebenes, mis viis kohese sepsise ja surmani. Faktid on see, et Houdini suri tõepoolest pimesoole rebenemise tõttu sepsisesse ja peritoniiti, kuid sellel polnud mingit pistmist kõhtu saadud löögiga. Pigem oli see seotud laialt levinud peritoniidi ja tõhusate antibiootikumide piiratud kättesaadavusega. [ 21 ], [ 22 ] Pimesool sisaldab aeroobseid ja anaeroobseid baktereid, sealhulgas Escherichia coli ja Bacteroides spp. Hiljutised uuringud, milles on kasutatud järgmise põlvkonna sekveneerimist, on aga tuvastanud oluliselt rohkem bakteritüüpe keerulise perforeeritud pimesoolepõletikuga patsientidel.
Teiste põhjuste hulka kuuluvad kivid, seemned, parasiidid nagu Enterobius vermcularis (surnukilised) ja mõned haruldased kasvajad, nii healoomulised (mucinoossed kasvajad) kui ka pahaloomulised (adenokartsinoom, neuroendokriinsed kasvajad).[ 23 ]
Riskitegurid
Ägeda pimesoolepõletikuga seotud riskitegurite uuringud on piiratud. Siiski on mõned tegurid, mis võivad potentsiaalselt mõjutada selle haiguse tekkimise tõenäosust, sealhulgas demograafilised tegurid, nagu vanus, sugu, perekonna ajalugu ning keskkonna- ja toitumistegurid. Uuringud näitavad, et äge pimesoolepõletik võib mõjutada igas vanuses inimesi, kuigi see näib olevat sagedasem noorukite ja noorte täiskasvanute seas, kusjuures meeste esinemissagedus on suurem.[ 24 ],[ 25 ] Nagu paljude teiste haiguste puhul, mängib perekonna ajalugu olulist rolli ägeda pimesoolepõletiku puhul; tõendid näitavad, et inimestel, kellel on esinenud ägedat pimesoolepõletikku perekonnas, on suurem risk haigestuda.[ 26 ] Pimesoolepõletikuga on seostatud mitmeid toitumisalaseid riskitegureid, näiteks kiudainevaene dieet, suurenenud suhkru tarbimine ja vähenenud vee tarbimine. [ 27 ] Pimesoolepõletiku tekkega seotud keskkonnategurite hulka kuuluvad kokkupuude õhusaastega, allergeenid, sigaretisuits ja seedetrakti infektsioonid. [ 28 ], [ 29 ], [ 30 ]
Uued tõendid viitavad võimalikule seosele kõrgenenud temperatuuri ja ägeda pimesoolepõletiku vahel, mis viitab sellele, et kõrge temperatuur võib suurendada dehüdratsioonist tingitud seisundi tekkimise tõenäosust.[ 31 ]
Uuringud on samuti näidanud, et psüühikahäiretega patsientidel, kellele määratakse iga päev suuri antipsühhootikumide annuseid, on suurem risk keerulise pimesoolepõletiku tekkeks.[ 32 ]
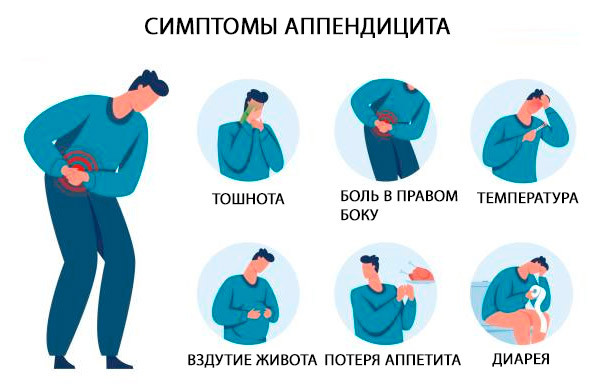
Sümptomid pimesoolepõletik
Ägeda pimesoolepõletiku klassikalisteks sümptomiteks on valu epigastimaalses või nabaväädi piirkonnas, millega kaasneb lühiajaline iiveldus, oksendamine ja isutus; mõne tunni pärast liigub valu kõhu paremasse alumisse kvadrandisse. Valu süveneb köhimisel ja liikumisel. [ 33 ]
Apenditsiidi klassikalised tunnused lokaliseeruvad otse kõhu paremas alumises kvadrandis ja McBurney punktis (punkt, mis asub väljapoole 1/3 joonel, mis ühendab naba ja eesmist ülemist niudeluulüli), kus valu tuvastatakse palpeerimise ajal rõhu järsu langusega (nt Štšetkin-Blumbergi sümptom). [ 34 ]
Lisatunnuste hulka kuuluvad valu, mis tekib paremas alumises kvadrandis vasaku alumise kvadrandi palpeerimisel (Rovsingi tunnus), suurenenud valu parema puusaliigese passiivse painutamise ajal, mis tõmbub kokku niude-nimmelihasega (psoase tunnus), või valu, mis tekib painutatud puusa passiivse sissepoole rotatsiooni ajal (obturaatori tunnus). Sageli esineb madalat palavikku [pärasoole temperatuur 37,7–38,3 °C (100–101 °F)]. [ 35 ]
Kahjuks täheldatakse neid klassikalisi märke veidi enam kui 50%-l patsientidest. Sümptomite ja nähtude variatsioonid on erinevad.
Apenditsiidi valu ei pruugi olla lokaliseeritud, eriti imikutel ja lastel. Hellus võib olla difuusne või harva puudub. Roojamine on tavaliselt haruldane või puudub üldse; kõhulahtisuse tekkimisel tuleks kahtlustada pimesoole retrotsekaalset paiknemist. Uriinis võib esineda punaseid või valgeid vereliblesid. Ebatüüpilised sümptomid on levinud eakatel patsientidel ja rasedatel; eriti valu ja lokaalne hellus võivad olla kerged.[ 36 ]
Ägeda pimesoolepõletiku anatoomilised aspektid
Pimesool on torukujuline struktuur, mis kinnitub pimesoole alusele kohas, kust sisenevad taeniae coli bakterid. Täiskasvanutel on see umbes 8–10 cm pikk ja esindab suure pimesoole vähearenenud distaalset otsa, mida on näha ka teistel loomadel. Inimestel peetakse seda vestigiaalseks organiks ja selle struktuuri ägedat põletikku nimetatakse ägedaks pimesoolepõletikuks.
Retrotsekaalne/retrokooliline (75%) – sageli kaasneb sellega valu paremal pool nimmepiirkonnas, hellus uuringul. Lihasjäikus ja -hellus sügaval palpatsioonil sageli puuduvad, kuna need on kaitstud pealmise pimesoole eest. Selles asendis võib psoas-lihas olla ärritunud, põhjustades puusa painutamist ja valu suurenemist puusa sirutamisel (psoas-lihase venituse märk).
Subsecum ja vaagnapiirkond (20%) - domineerivaks võivad olla suprapubiline valu ja sagedane urineerimine. Kõhulahtisus võib tuleneda pärasoole ärritusest. Kõhuvalu võib puududa, kuid paremal pool võib esineda pärasoole või tupe valulikkus. Uriinianalüüsis võivad esineda mikroskoopiline hematuuria ja leukotsüüdid.
Pre- ja postileaalne (5%) – nähud ja sümptomid võivad puududa. Oksendamine võib olla tugevam ja distaalse ileumi ärritus võib põhjustada kõhulahtisust.
Apenditsiidi sümptomid lastel
Lastel on pimesoolepõletiku sümptomid vanuserühmade lõikes varieeruvad. [ 37 ] Vastsündinutel ja imikutel on see haruldane ja raskesti diagnoositav. [ 38 ] Tavaliselt avalduvad need kõhu paisumise, oksendamise, kõhulahtisuse, palpiseeritava kõhumassi ja ärrituvusena. [ 39 ] Füüsilisel läbivaatusel ilmnevad sageli dehüdratsioon, hüpotermia ja hingamisraskused, mistõttu on pimesoolepõletiku diagnoosi panemine arsti jaoks ebatõenäoline. Kuni 3-aastastel eelkooliealistel lastel esineb tavaliselt oksendamine, kõhuvalu, valdavalt difuusne palavik, kõhulahtisus, kõndimisraskused ja parema kubeme jäikus. [ 40 ] Hinnang võib rektaalsel uuringul paljastada kõhu paisumise, jäikuse või massi. [ 41 ] 5-aastastel ja vanematel lastel esinevad tõenäolisemalt klassikalised sümptomid, sealhulgas rännak kõhuvalu, isutus, iiveldus ja oksendamine. Kliinilisel hindamisel ilmneb palavik ja tahhükardia, nõrgenenud soolehääled ja parema alumise kvadrandi tundlikkus, mis suurendab diagnoosi tõenäosust selles vanuserühmas.[ 42 ] Äge pimesoolepõletik avaldub väikelastel tavaliselt ebatüüpiliselt, kattuvate sümptomitega, mis jäljendavad teisi süsteemseid haigusi, mis sageli viib valediagnoosimise ja tüsistusteni, mis omakorda põhjustavad haigestumust. Lisaks on noorem vanus tuntud riskitegur keerulise pimesoolepõletiku tõttu tekkivate kõrvaltoimete tekkeks.[ 43 ]
Täiskasvanutel esineva pimesoolepõletiku tüüpilisteks sümptomiteks on migreeruv valu paremas niudeluuõõnes, isutus, iiveldus koos oksendamisega või ilma, palavik ja lokaalne/generaliseerunud jäikus.[ 44 ],[ 45 ] Klassikaline sümptomite jada hõlmab ebamäärast nabavalu, isutust/iiveldust/mööduvat oksendamist, migreeruvat valu paremas alumises kvadrandis ja madalat palavikku.
Apenditsiidi ebatüüpilised nähud ja sümptomid
Lisaks pimesoolepõletiku tüüpilisele avaldumisele võib täheldada ka atüüpilisi märke ja sümptomeid. Nende hulka võib kuuluda vasakpoolne kõhuvalu, mis lokaliseerub vasakusse ülakvadrandisse. Kuigi vasakpoolne pimesoolepõletik on suhteliselt haruldane, esinedes umbes 0,02%-l täiskasvanud elanikkonnast, on see sagedasem inimestel, kellel on soole malrotatsioon või sissepoole pööratud soole asend.[ 46 ] Pimesoolepõletikuga kaasneb ka kõhulahtisus kui dissemineerunud pimesoolepõletiku atüüpiline sümptom, eriti patsientidel, kellel on soolestikuvahelised abstsessid.[ 47 ]
Lastel on sümptomid üldiselt ebamäärased, mistõttu on diagnoosimine anamneesi ja läbivaatuse põhjal keeruline. Laste pimesoolepõletiku atüüpiline avaldumine võib hõlmata valu ja hellust kogu paremal küljel, ulatudes paremast ülakvadrandist parema niudeluu lohuni. See võib tuleneda pimesoole laskumise peatusest, kusjuures pimesool on subhepaatilises asendis.[ 48 ] Täiskasvanud meestel võivad esineda pimesoolepõletiku atüüpilised sümptomid, näiteks tugev parempoolne hemipleegiline valu, mis hiljem muutub kergeks difuusseks kõhuvaluks. Seevastu naistel võivad esineda urogenitaalsüsteemi kaebused, näiteks reie hellus koos massi ja kõhulahtisusega.[ 49 ],[ 50 ] Eakatel võib pimesoolepõletik avalduda atüüpiliselt kinnijäänud kubemesongana, millel on mittespetsiifilised sümptomid.[ 51 ]
Rasedatel patsientidel esineb tõenäolisemalt ebatüüpilisi kaebusi, nagu gastroösofageaalne refluks, halb enesetunne, vaagnavalu, ebamugavustunne ülakõhus, seedehäired, kõhupuhitus, düsuuria ja muutused roojamises.[ 52 ] Lisaks on füüsilise läbivaatuse tulemused keerulised ja ebanormaalsed, kuna kõht on paisunud, suurendades põletikulise pimesoole ja kõhukelme vahelist kaugust, mille tulemuseks on jäikuse varjamine ja helluse vähenemine. Raseduse lõpus võib pimesool suureneva emaka tõttu kolju suunas ülakõhusse nihkuda, mille tulemuseks on RUQ-valu.[ 53 ] Siiski, olenemata rasedusajast, on RLQ-valu raseduse ajal ägeda pimesoolepõletiku kõige levinum kliiniline ilming.[ 54 ] Leukotsütoos ei pruugi olla usaldusväärne ägeda pimesoolepõletiku näitaja rasedatel naistel raseduse ajal esineva füsioloogilise leukotsütoosi tõttu. Uuringud on näidanud, et rasedatel naistel on pimesoolepõletiku esinemissagedus väiksem kui mitterasedatel. Siiski on teisel trimestril suurem ägeda pimesoolepõletiku tekkerisk.[ 55 ]
Tüsistused ja tagajärjed
Ägeda pimesoolepõletikuga seotud domineerivad mikroobsed floora on E. coli, Kleibciella, Proteus ja Bacteroides (Altemeier 1938 [ 56 ]; Leigh 1974 [ 57 ]; Bennion 1990 [ 58 ]; Blewett 1995 [ 59 ]). Need mikroobid võivad põhjustada postoperatiivset infektsiooni, olenevalt pimesoolepõletiku astmest, kirurgilisest tehnikast ja operatsiooni kestusest. [ 60 ]
Pimesoole perforatsioon
Pimesoole perforatsioon on seotud suurenenud haigestumuse ja suremusega võrreldes mitteperforeeruva ägeda pimesoolepõletikuga. Suremuse risk ägeda, kuid mittegangrenoosse ägeda pimesoolepõletiku korral on alla 0,1%, kuid gangrenoosse ägeda pimesoolepõletiku korral suureneb risk 0,6% -ni. Teisest küljest on perforeeritud ägeda pimesoolepõletiku suremus kõrgem, umbes 5%. Nüüd on üha rohkem tõendeid, mis viitavad sellele, et perforatsioon ei ole tingimata pimesoole obstruktsiooni vältimatu tagajärg, ning üha rohkem tõendeid viitab nüüdseks mitte ainult sellele, et mitte kõigil pimesoole perforatsiooniga patsientidel ei teki perforatsiooni, vaid et paranemine võib olla isegi sagedane.[ 61 ]
Postoperatiivne haavainfektsioon
Postoperatiivse haavainfektsiooni esinemissagedust määrab intraoperatiivne haava saastumine. Infektsiooni esinemissagedus varieerub < 5%-st lihtsa pimesoolepõletiku korral kuni 20%-ni perforatsiooni ja gangreeni korral. Perioperatiivsete antibiootikumide kasutamine on näidanud, et see vähendab postoperatiivsete haavainfektsioonide esinemissagedust.
Kõhuõõne või vaagna abstsessid
Postoperatiivsel perioodil võivad kõhuõõnesisesed või vaagnaabstsessid tekkida, kui kõhukelme on tugevalt saastunud. Patsiendil on palavik ja diagnoosi saab kinnitada ultraheli või kompuutertomograafia abil. Abstsesse saab radiograafiliselt ravida patside drenaažiga, kuigi vaagnaabstsessid võivad vajada avatud või rektaalset drenaaži. Perioperatiivsete antibiootikumide kasutamine on näidanud abstsesside esinemissageduse vähenemist.
Peritoniit
Kui pimesool lõhkeb, nakatub kõhu limaskest (kõhukelme) bakteritega. Seda seisundit nimetatakse peritoniidiks.
Peritoniidi sümptomiteks võivad olla:
- tugev, pidev kõhuvalu;
- iiveldust tundma või haige olema;
- kõrge temperatuur;
- suurenenud südame löögisagedus;
- õhupuudus koos kiire hingamisega;
- puhitus.
Kui peritoniiti ei ravita kohe, võib see põhjustada pikaajalisi probleeme ja isegi surma.
Diagnostika pimesoolepõletik
Alvarado skoori saab kasutada pimesoolepõletikule viitavate sümptomitega patsientide stratifitseerimiseks; skoori usaldusväärsus konkreetsetes patsientide rühmades ja erinevates punktides on endiselt ebaselge. Alvarado skoor on kasulik diagnostiline välistav skoor, mille piirväärtus on kõigi patsientide rühmade puhul 5. See on meeste puhul hästi kalibreeritud, laste puhul ebajärjekindel ja ennustab pimesoolepõletiku tõenäosust naistel kõigis riskirühmades üle.[ 62 ]
Alvarado skoor võimaldab kõhuvaluga patsientidel riski hindamist, seostades pimesoolepõletiku tõenäosuse väljakirjutamise, jälgimise või operatsiooni soovitustega.[ 63 ] Kui pimesoolepõletiku tõenäosus on vahepealses vahemikus, on soovitatavad täiendavad uuringud, näiteks ultraheli ja kompuutertomograafia (KT).[ 64 ] Ajaline viivitus, kõrge hind ja pildistamisprotseduuride varieeruv kättesaadavus tähendavad aga seda, et Alvarado skoor võib olla väärtuslik diagnostiline abivahend, kui kahtlustatakse pimesoolepõletikku ägeda kõhuvalu algpõhjuseks, eriti väheste ressurssidega keskkondades, kus pildistamine pole saadaval.
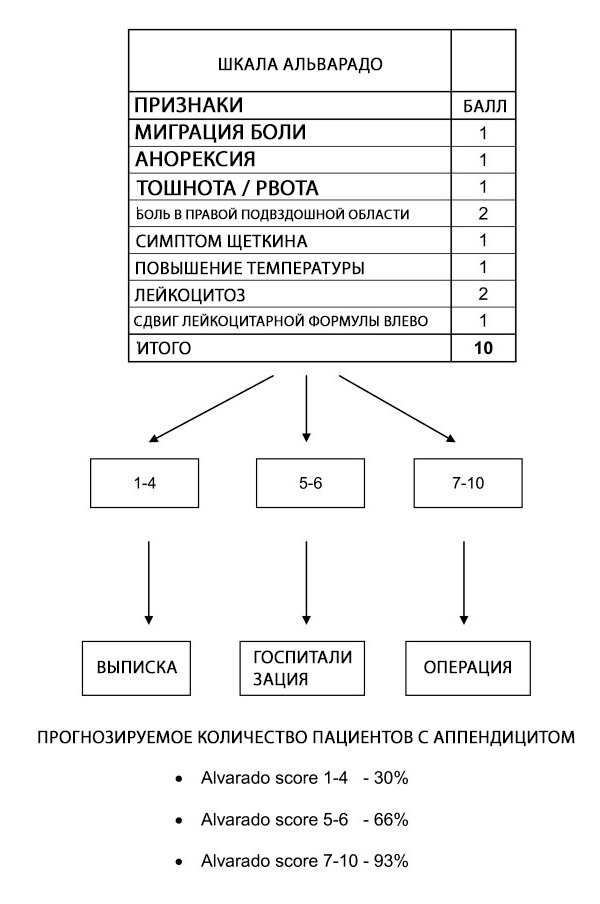
Kuigi Alvarado skooril puudub AA diagnoosimiseks spetsiifilisus, on piirväärtus <5 piisavalt tundlik, et välistada äge pimesoolepõletik (99% tundlikkus). Seega saab Alvarado skoori kasutada ägeda pimesoolepõletiku kahtlusega patsientide erakorralise meditsiini osakonnas viibimise aja ja kiirgusdoosi vähendamiseks. Seda toetab ka ulatuslik retrospektiivne kohortuuring, mis leidis, et 100%-l meestest, kelle Alvarado skoor oli 9 või rohkem, ja 100%-l naistest, kelle Alvarado skoor oli 10, oli kirurgilise patoloogiaga kinnitatud äge pimesoolepõletik. Seevastu diagnoositi operatsiooni ajal äge pimesoolepõletik 5%-l või vähemal naispatsientidest, kelle Alvarado skoor oli 2 või vähem, ja 0%-l meespatsientidest, kelle Alvarado skoor oli 1 või vähem.[ 65 ]
Alvarado skaala ei erista aga eakatel patsientidel tüsistuslikku ja tüsistusteta ägedat pimesoolepõletikku ning tundub olevat vähem tundlik HIV-positiivsete patsientide puhul.[ 66 ],[ 67 ]
RIPASA (Raja Isteri Pengiran Anak Saleh apenditsiit) skoor näitas Aasia ja Lähis-Ida populatsioonides paremat tundlikkust ja spetsiifilisust kui Alvarado skoor. Malik jt avaldasid hiljuti esimese uuringu, milles hinnati RIPASA skoori kasulikkust ägeda apenditsiidi ennustamisel lääne populatsioonis. Väärtusega 7,5 (skoor, mis näitab ägedat apenditsiiti idapopulatsioonis) näitas RIPASA mõistlikku tundlikkust (85,39%), spetsiifilisust (69,86%), positiivset ennustusväärtust (84,06%), negatiivset ennustusväärtust (72,86%) ja diagnostilist täpsust (80%) Iiri patsientidel, kellel kahtlustati AA-d, ning oli täpsem kui Alvarado skoor.[ 68 ]
Täiskasvanute pimesoolepõletiku skoor (AAS) jagab patsiendid kolme rühma: kõrge, keskmise ja madala ägeda pimesoolepõletiku riskiga. See skoor on osutunud usaldusväärseks vahendiks patsientide stratifitseerimiseks selektiivseks pildistamiseks, mille tulemuseks on madal negatiivsete pimesoolepõletike määr. Prospektiivses uuringus, milles osales 829 täiskasvanut, kellel oli kliiniline ägeda pimesoolepõletiku kahtlus, oli 58%-l histoloogiliselt kinnitatud ägeda pimesoolepõletikuga patsientidest skoor vähemalt 16 ja nad liigitati kõrge tõenäosusega rühmaks spetsiifilisusega 93%. Patsiendid, kelle skoor oli alla 11, liigitati madala ägeda pimesoolepõletiku tõenäosusega rühmaks. Ainult 4%-l ägeda pimesoolepõletikuga patsientidest oli skoor alla 11 ja kellelgi neist ei olnud ägeda pimesoolepõletiku tüsistusi. Seevastu 54%-l mitte-AA patsientidest oli skoor alla 11. ROC-kõvera alune pindala oli uue skooriga 0,882 oluliselt suurem võrreldes Alvarado skoori AUC-ga 0,790 ja AIR-iga 0,810.[ 69 ]
Alvarado skoor võib rasedatel naistel olla kõrgem kõrgemate leukotsüütide väärtuste ja iivelduse ning oksendamise esinemissageduse tõttu, eriti esimesel trimestril, mille tulemuseks on madalam täpsus võrreldes mitterasedate populatsiooniga. Uuringud näitavad, et Alvarado skoori tundlikkus (piirväärtus 7 punkti) on rasedatel 78,9% ja spetsiifilisus 80,0%.[ 70 ],[ 71 ] RIPASA skoori spetsiifilisus (piirväärtus 7,5 punkti) on 96%, kuid seda tuleb suuremates uuringutes kinnitada. Alvarado skoori kohta puuduvad uuringud, mis võimaldaksid eristada tüsistusteta ja tüsistustega AA-d raseduse ajal.
Klassikaliste sümptomite ja tunnuste esinemisel tehakse diagnoos kliiniliselt. Sellistel patsientidel suurendab laparotoomia edasilükkamine täiendavate instrumentaalsete uuringute tõttu ainult perforatsiooni ja järgnevate tüsistuste tõenäosust. Ebatüüpiliste või küsitavate andmetega patsientidel tuleks instrumentaalsed uuringud läbi viia viivitamatult.
Kontrastainega kompuutertomograafial on apenditsiidi diagnoosimisel mõistlik täpsus ja selle abil saab kontrollida ka ägeda kõhuvalu muid põhjuseid. Astmelise kompressioonultraheli abil saab tavaliselt teha kiiremini kui kompuutertomograafiat, kuid uuringut piirab mõnikord gaasi olemasolu soolestikus ja see on vähem informatiivne mitte-apenditsiaalse valu põhjuste diferentsiaaldiagnostikas. Nende uuringute kasutamine on vähendanud negatiivsete laparotoomiate protsenti.
Diagnoosimiseks võib kasutada laparoskoopiat; uuring on eriti kasulik naistel, kellel on seletamatu alakõhuvalu. Laboratoorsed uuringud näitavad tavaliselt leukotsütoosi (12 000–15 000/μl), kuid need leiud on väga varieeruvad; leukotsüütide arvu ei tohiks kasutada pimesoolepõletiku välistamise kriteeriumina.
Erakorralise meditsiini osakonna arst peaks hoiduma patsiendile valuvaigistite väljakirjutamisest enne, kui patsient on kirurgi juures käinud. Valuvaigistid võivad varjata kõhukelme sümptomeid ja viia diagnoosi edasilükkamiseni või isegi pimesoole rebenemiseni.
Laboratoorsed testid
Laboratoorsed mõõtmised, sh valgete vereliblede (WBC) koguarv, neutrofiilide protsent ja C-reaktiivse valgu (CRP) kontsentratsioon, on diagnostilise uurimistöö jätkamiseks hädavajalikud ägeda pimesoolepõletiku kahtlusega patsientidel.[ 72 ] Klassikaliselt esineb kõrgenenud valgete vereliblede (WBC) arv koos vasakule nihke või bandeemiaga või ilma, kuid kuni kolmandikul ägeda pimesoolepõletikuga patsientidest on normaalne valgete vereliblede arv. Ketoneid tuvastatakse sageli uriinis ja C-reaktiivse valgu tase võib olla kõrgenenud. Normaalsete valgete vereliblede ja CRP tulemuste kombinatsiooni spetsiifilisus ägeda pimesoolepõletiku välistamiseks on 98%. Lisaks on valgete vereliblede ja CRP tulemustel positiivne ennustusväärtus põletikuta, tüsistusteta ja keerulise pimesoolepõletiku eristamisel. Nii CRP kui ka valgete vereliblede taseme tõus korreleerub keerulise pimesoolepõletiku oluliselt suurenenud tõenäosusega. Apenditsiidi tekkimise tõenäosus patsiendil, kellel on normaalsed valgete vereliblede ja CRP väärtused, on äärmiselt madal. [ 73 ] Leukotsüütide arv 10 000 rakku/mm^3 on ägeda pimesoolepõletikuga patsientidel üsna prognoositav; tüsistusliku pimesoolepõletikuga patsientidel on see tase aga kõrgem. Seega seostatakse leukotsüütide arvu 17 000 rakku/mm^3 või rohkem ägeda pimesoolepõletiku tüsistustega, sealhulgas perforeeritud ja gangrenoosse pimesoolepõletikuga.
Visualiseerimine
Apenditsiit on traditsiooniliselt kliiniline diagnoos. Diagnostiliste sammude juhtimiseks kasutatakse aga mitmeid pildistamismeetodeid, sealhulgas kõhu kompuutertomograafiat, ultraheli ja magnetresonantstomograafiat.
Kompuutertomograafia
Kõhu kompuutertomograafia (KT) täpsus pimesoolepõletiku diagnoosimisel on >95% ja seda kasutatakse üha enam. KT kriteeriumid pimesoolepõletiku diagnoosimiseks on suurenenud pimesool (läbimõõt >6 mm), paksenenud pimesoole sein (>2 mm), periappendikaalne rasva kogunemine, pimesoole seina kontrasteerumine ja pimesoolekivi olemasolu (umbes 25% patsientidest). Õhu või kontrastaine nägemine pimesoolepõletiku korral on ebatavaline, kuna enamikul pimesoolepõletiku juhtudest on valendik laienenud ja võimalik obstruktsioon. Pimesoole visualiseerimata jätmine ei välista pimesoolepõletikku. Ultraheli on vähem tundlik ja spetsiifiline kui KT, kuid see võib olla kasulik ioniseeriva kiirguse vältimiseks lastel ja rasedatel. MRI võib olla kasulik ka rasedatel naistel, kellel kahtlustatakse pimesoolepõletikku ja ultraheli tulemus on ebamäärane. Klassikaliselt on parim viis ägeda pimesoolepõletiku diagnoosimiseks hea anamnees ja põhjalik füüsiline läbivaatus kogenud kirurgi poolt; aga KT-uuringu saamine on erakorralise meditsiini osakonnas väga lihtne. Ägeda pimesoolepõletiku diagnoosimisel on tavaks saanud peamiselt KT-uuringutele tugineda. Mõnikord avastatakse pimesoolepõletik juhuslikult tavaliste röntgen- või kompuutertomograafiauuringute käigus.
Kompuutertomograafia näitab ägeda pimesoolepõletiku põhjustatud põletikulist massi paremas niudeluuõõnes.
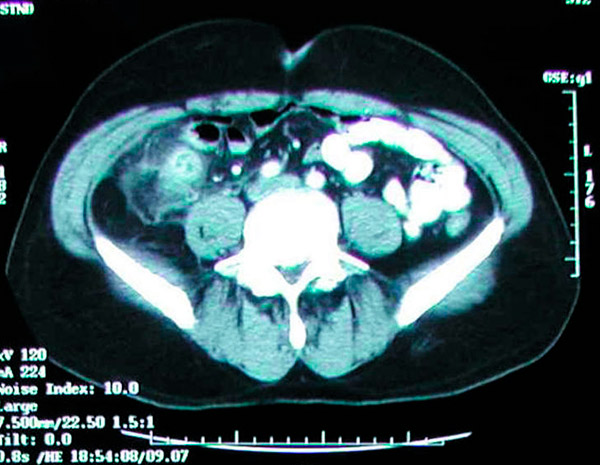
Kõhu- ja vaagna kompuutertomograafia peamine mure on kiirgusdoos; tüüpilise kompuutertomograafia keskmine kiirgusdoos ei ületa aga 4 mSv, mis on veidi kõrgem kui peaaegu 3 mSv suurune taustkiirgus. Vaatamata maksimaalse kiirgusdoosiga 4 mSv saadud kompuutertomograafia piltide kõrgemale lahutusvõimele, ei mõjuta madalamad doosid kliinilisi tulemusi. Lisaks peaks ägeda pimesoolepõletiku kahtlusega patsientidel intravenoosse kontrastainega tehtud kõhu- ja vaagna kompuutertomograafia piirduma vastuvõetava glomerulaarfiltratsioonikiirusega (GFR) 30 ml/min või suuremaga. Nendel patsientidel on suurem risk pimesoolepõletiku tekkeks kui üldpopulatsioonis. Nendel patsientidel tuleks kaaluda profülaktilist pimesoolepõletikku. Uuringud on ka näidanud, et ägeda pimesoolepõletiku korral tehtud pimesoolepõletiku proovides pimesoolekivide esinemissagedus on vahemikus 10% kuni 30%. [ 74 ], [ 75 ], [ 76 ]
Ultraheli ehhograafia
Kõhu ultraheli on laialdaselt kasutatav ja taskukohane esmane uuring ägeda kõhuvaluga patsientidel. Apenditsiidi välistamiseks kasutatakse spetsiifilist kokkusurutavuse indeksit, mis on alla 5 mm läbimõõduga. Seevastu teatud leiud, sealhulgas anteroposteriorne läbimõõt üle 6 mm, apendikuliidid ja periappendikaalkoe ebanormaalselt suurenenud ehhogeensus, viitavad ägedale apenditsiidile. Peamised probleemid kõhu ultraheli kasutamisel ägeda apenditsiidi võimaliku diagnoosi hindamiseks hõlmavad sonograafia loomupäraseid piiranguid rasvunud patsientidel ja operaatori sõltuvust viitavate tunnuste tuvastamisel. Lisaks on astmelist kokkusurumist raske taluda peritoniidiga patsientidel.[ 77 ]
MRI
Vaatamata MRI kõrgele tundlikkusele ja spetsiifilisusele ägeda pimesoolepõletiku avastamisel, on kõhupiirkonna MRI tegemisega olulisi probleeme. Kõhupiirkonna MRI tegemine pole mitte ainult kallis, vaid nõuab ka tulemuste tõlgendamiseks kõrgetasemelist asjatundlikkust. Seetõttu piirduvad selle näidustused suures osas erirühmadega, sealhulgas rasedatega, kellel on vastuvõetamatu kiirgusdoosi risk. [ 78 ]
Mida tuleb uurida?
Kuidas uurida?
Diferentseeritud diagnoos
Diferentsiaaldiagnoos hõlmab Crohni tõbe, mesenteerilist adeniiti, umbsoole divertikuli põletikku, Mittelschmerzi sündroomi, salpingiiti, munasarjatsüsti rebendit, emakavälist rasedust, tubo-munasarja abstsessi, lihasluukonna vaevusi, endometrioosi, vaagna põletikulist haigust, gastroenteriiti, parempoolset koliiti, neerukoolikke, neerukive, ärritunud soole sündroomi, munandi torsiooni, munasarja torsiooni, ümarsideme sündroomi, epididümiiti ja muid mittemääraseid seedetrakti probleeme. Diferentsiaaldiagnooside välistamiseks on vajalik üksikasjalik haiguslugu ja probleemile orienteeritud füüsiline läbivaatus. Seega viitab hiljutine viirusinfektsioon üldiselt ägedale mesenteerilisele adeniidile ja süvenevale tugevale valulikkusele koos emakakaela liikumisega transvaginaalse uuringu ajal, mida sageli täheldatakse vaagna põletikulise haiguse korral. Üks keerulisi diferentsiaaldiagnoose on äge Crohni tõbi. Kuigi Crohni tõve positiivne anamnees varasemas faasis võib vältida tarbetuid kirurgilisi protseduure, võib Crohni tõbi esmakordselt avalduda ägedalt, jäljendades ägedat pimesoolepõletikku. Põletikulise iileumi olemasolu operatsiooni ajal peaks tekitama kahtluse Crohni tõvele koos teiste ägeda ileiidi bakteriaalsete põhjustega, sh Yersinia või Campylobacter ileiit. Eelistatud lähenemisviis on apendektoomia isegi ägeda apenditsiidi tunnuste puudumisel. Patsientidel, kellel esinevad ileiidi tunnused koos pimesoole põletikuga, on apendektoomia aga vastunäidustatud, kuna see raskendab protseduuri veelgi. [ 79 ]
Kellega ühendust võtta?
Ravi pimesoolepõletik
Mitteoperatiivse ravi (NOM) eesmärk on võimaldada patsientidel antibiootikumide abil kirurgilist sekkumist vältida.[ 80 ] Varased uuringud 1950. aastatel teatasid ägeda pimesoolepõletiku edukast ravist ainult antibiootikumidega ja soovitasid ravida pimesoolepõletikku, mille sümptomid kestsid alla 24 tunni.[ 81 ],[ 82 ] Viimastel aastatel on taas tekkinud huvi tüsistusteta ägeda pimesoolepõletiku NOM-i vastu ning mitmed uuringud on teatanud umbes 65% juhtudest edukast ravist ainult antibiootikumidega. Sellised uuringud nagu APPAC, ACTUAA ja metaanalüüsid on aga näidanud erinevaid tulemusi, kusjuures lühi- ja pikaajalise NOM-i ebaõnnestumise määr on vahemikus 11,9% kuni 39,1%.[ 83 ] Lisaks on NOM-i kasutamise kohta keerulise pimesoolepõletiku korral uuringuid piiratud, kuid need on näidanud, et kuigi see võib olla edukas, on see seotud suurenenud taashospitaliseerimise määra ja pikema haiglas viibimisega.[ 84 ],[ 85 ]
Ägeda pimesoolepõletiku ravi seisneb põletikulise pimesoole eemaldamises; kuna suremus suureneb ravi hilinemisega, peetakse 10% negatiivse pimesoole eemaldamise määra vastuvõetavaks. Kirurg eemaldab pimesoole tavaliselt isegi siis, kui see on perforeeritud. Mõnikord on pimesoole asukohta raske kindlaks teha: sellistel juhtudel asub pimesool tavaliselt umbsoole või niudesoole taga või käärsoole parema külje mesenteeriumi taga.
Apendektoomia vastunäidustuste hulka kuulub pimesoole haarav põletikuline soolehaigus. Terminaalse ileiidi korral, kui pimesool on terve, tuleks pimesool eemaldada.
Pimesoole eemaldamisele peaks eelnema intravenoosne antibiootikumide manustamine. Eelistatakse kolmanda põlvkonna tsefalosporiine. Tüsistusteta pimesoolepõletiku korral pole edasist antibiootikumravi vaja. Perforatsiooni korral tuleb antibiootikumravi jätkata, kuni patsiendi temperatuur ja leukotsüütide arv normaliseeruvad (umbes 5 päeva). Kui operatsioon pole võimalik, parandavad antibiootikumid, kuigi mitte ravi, oluliselt elulemust. Ilma operatsiooni või antibiootikumravita ulatub suremus üle 50%.
Erakorralise meditsiini osakonnas ei tohiks patsient saada suukaudset vedelikku ja talle tuleks manustada intravenoosselt kristalloidlahuseid ning antibiootikume tuleks manustada intravenoosselt vastavalt kirurgi juhistele. Nõusolek on kirurgi kohustus. Ägeda pimesoolepõletiku kuldstandardravi on pimesoole eemaldamine. Laparoskoopilist pimesoole eemaldamist eelistatakse avatud meetodile. Enamik tüsistusteta pimesoole eemaldamise operatsioone tehakse laparoskoopiliselt. Mitmed uuringud on võrrelnud laparoskoopilise pimesoole eemaldamise rühma tulemusi avatud pimesoole eemaldamise läbinud patsientidega. Tulemused näitasid esimeses rühmas madalamat haavainfektsiooni määra, väiksemat vajadust postoperatiivsete valuvaigistite järele ja lühemat postoperatiivset haiglas viibimist. Laparoskoopilise pimesoole eemaldamise peamine puudus on pikem operatsiooniaeg.[ 86 ]
Tööaeg
Hiljutine retrospektiivne uuring ei leidnud olulist erinevust tüsistuste osas varajase (<12 tundi pärast pöördumist) ja hilise (12–24 tundi) pimesoole eemaldamise vahel.[ 87 ] See ei võta aga arvesse tegelikku aega sümptomite ilmnemisest kuni pöördumiseni, mis võib mõjutada perforatsiooni määra.[ 88 ] Pärast esimest 36 tundi sümptomite ilmnemisest on keskmine perforatsiooni määr 16–36% ja perforatsiooni risk on 5% iga järgneva 12 tunni jooksul.[ 89 ] Seetõttu tuleks pärast diagnoosi panemist pimesoole eemaldamine teha ilma tarbetu viivituseta.
Laparoskoopiline apendektoomia
Abstsessi või kaugelearenenud infektsiooni korral võib osutuda vajalikuks avatud lähenemine. Laparoskoopiline lähenemine pakub vähem valu, kiiremat taastumist ja võimalust uurida suuremat osa kõhust väikeste sisselõigete kaudu. Olukordades, kus on teadaolev perforeeritud pimesoole abstsess, võib vaja minna perkutaanset drenaažiprotseduuri, mida tavaliselt viib läbi interventsiooniline radioloog. See stabiliseerib patsiendi seisundit ja annab põletikul aega vaibuda, võimaldades hiljem teha vähem keerulist laparoskoopilist pimesoole eemaldamist. Praktikud määravad patsientidele ka laia toimespektriga antibiootikume. Antibiootikumide preoperatiivse kasutamise osas tüsistusteta pimesoolepõletiku korral on teatud poleemikat. Mõned kirurgid usuvad, et antibiootikumide rutiinne kasutamine on nendel juhtudel sobimatu, samas kui teised määravad neid rutiinselt.
Pimesoole abstsessiga patsientidel jätkavad mõned kirurgid antibiootikumravi mitu nädalat ja teevad seejärel plaanilise pimesoole eemaldamise. Rebenenud pimesoole korral saab protseduuri läbi viia laparoskoopiliselt, kuid vajalik on kõhu ja vaagna ulatuslik loputamine. Lisaks võib trokaari kohad olla vaja jätta avatuks. Märkimisväärset hulka ägeda pimesoolepõletiku kahtlusega patsiente saab tüsistusteta ravida laparoskoopilise lähenemisviisi abil. Avatud lähenemisviisile ülemineku vajadust ennustavad aga mitmed tegurid. Ainus preoperatiivne sõltumatu tegur, mis ennustab üleminekut laparoskoopilisele pimesoole eemaldamisele, on kaasuvate haiguste olemasolu. Lisaks on mitmed intraoperatiivsed leiud, sealhulgas periappenditsaalse abstsessi ja difuusse peritoniidi olemasolu, sõltumatud ennustajad mitte ainult kõrgemale konversioonimäärale, vaid ka postoperatiivsete tüsistuste olulisele suurenemisele.[ 90 ]
Avatud pimesoole eemaldamine
Kuigi laparoskoopilist apendektoomiat kasutatakse paljudes keskustes laialdaselt ägeda pimesoolepõletiku eelistatud kirurgilise ravina, võib avatud apendektoomia siiski valida praktilise võimalusena, eriti keerulise tselluliidiga pimesoolepõletiku ravis ja patsientidel, kes on läbinud laparoskoopilisest lähenemisviisist kirurgilise ülemineku, peamiselt halva nähtavusega seotud võimalike probleemide tõttu.
Alternatiivsed kirurgilised lähenemisviisid
Hiljuti on kasutusele võetud mitu muud alternatiivset kirurgilist lähenemisviisi, sealhulgas loomuliku ava transluminaalne endoskoopiline kirurgia (NOTES) ja ühe sisselõikega laparoskoopiline kirurgia (SILS). Idee kasutada painduvat endoskoopi seedetrakti või tupe sisenemiseks ja seejärel nimetatud organi läbilõikamiseks kõhuõõnde sisenemiseks on huvitav alternatiiv patsientidele, kes on protseduuride kosmeetiliste aspektide suhtes tundlikud. Hiljem testiti seda eduka transgastraalse apendektoomia käigus kümne India patsiendi rühmas. NOTES-i abil tehtava apendektoomia peamised potentsiaalsed eelised on armistumise puudumine ja postoperatiivse valu piiramine. Arvestades NOTES-i abil apendektoomiat läbivate patsientide piiratud arvu, pole postoperatiivsete tulemuste üksikasjalik võrdlus veel võimalik. Seetõttu on selle tehnika peamiseks puuduseks vajadus kombineerida seda laparoskoopilise lähenemisega, et tagada protseduuri ajal piisav retraktsiooni ja kinnitada sisenemiskoha sulgemist. [ 91 ], [ 92 ], [ 93 ] Kirurgilise tehnikana tehakse SILS-i apendektoomia korral nabanööri sisselõike või olemasoleva kõhuarmi kaudu. SILS-i võimalike eeliste hulka kuuluvad vähenenud postoperatiivne valu, protseduurijärgsed haavakomplikatsioonid ja sellest tulenevad lühemad haiguslehed. [ 94 ] Siiski läheb kuni 40% patsientidest protseduuri ajal mingil hetkel üle traditsioonilisele laparoskoopiale. SILS-i peamine puudus pimesoole eemaldamisel on intsisioonisongaga seotud suurem pikaajaline tüsistuste oht.
Ulatusliku põletikulise ruumi hõivava kahjustuse avastamisel, mis hõlmab pimesoolt, distaalset iileumi ja pimesoolt, on eelistatav kogu kahjustuse resektsioon ja ileostoomia.
Kaugelearenenud juhtudel, kui perikooliline abstsess on juba moodustunud, tühjendatakse viimane perkutaanselt ultraheli kontrolli all sisestatud sondiga või avatud operatsiooniga (millele järgneb pimesoole edasilükatud eemaldamine). Meckkeli divertikuli eemaldamine toimub paralleelselt pimesoole eemaldamisega, kuid ainult juhul, kui pimesoole ümbritsev põletik seda protseduuri ei sega.
Rohkem informatsiooni ravi kohta
Prognoos
Õigeaegse kirurgilise sekkumise korral on suremus alla 1% ning taastumine on tavaliselt kiire ja täielik. Tüsistuste (perforatsioon ja abstsessi või peritoniidi teke) korral on prognoos halvem: võimalikud on korduvad operatsioonid ja pikaajaline taastumine.

