
Kõik iLive'i sisu vaadatakse meditsiiniliselt läbi või seda kontrollitakse, et tagada võimalikult suur faktiline täpsus.
Meil on ranged allhanke juhised ja link ainult mainekate meediakanalite, akadeemiliste teadusasutuste ja võimaluse korral meditsiiniliselt vastastikuste eksperthinnangutega. Pange tähele, et sulgudes ([1], [2] jne) olevad numbrid on nende uuringute linkideks.
Kui tunnete, et mõni meie sisu on ebatäpne, aegunud või muul viisil küsitav, valige see ja vajutage Ctrl + Enter.
Inimese embrüonaalsetest tüvirakkudest on kasvatatud võrkkesta
Artikli meditsiiniline ekspert
Last reviewed: 01.07.2025
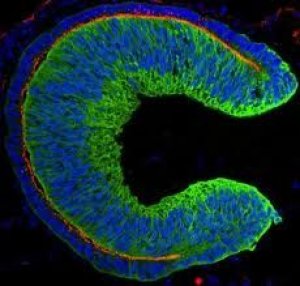
Ajakirjas Cell Stem Cell avaldatud artikli kohaselt moodustavad inimese tüvirakud spontaanselt kude, mis areneb võrkkestaks ehk silmakoeks, mis võimaldab meil näha. Tulevikus võiks selle 3D-koe siirdamine aidata nägemisprobleemidega patsiente.
„See on oluline verstapost regeneratiivse meditsiini järgmises etapis,“ ütles uuringu juht, Jaapani RIKENi arengubioloogia keskuse organogeneesi ja neurogeneesi grupi direktor, professor Yoshiki Sasai (MD, PhD). „Meie lähenemisviis avab uusi perspektiive inimese tüvirakkudest saadud keerukate kudede kasutamisele nii ravis kui ka patogeneesi ja ravimite väljatöötamisega seotud meditsiiniuuringutes.“
Arengu käigus moodustub võrkkest – silma sisemust vooderdav valgustundlik kude – struktuurist, mida tuntakse optilise tassina. Jaapani teadlaste uues töös moodustus see struktuur spontaanselt inimese embrüonaalsetest tüvirakkudest (hESC-dest) – inimembrüotest pärinevatest rakkudest, millel on potentsiaal diferentseeruda mitmesugusteks kudedeks. Selle tegid võimalikuks professor Sasai ja tema meeskonna optimeeritud rakukultuuri tehnikad.
HESC-st pärinevad rakud organiseeruvad korrapäraseks kolmemõõtmeliseks struktuuriks, millel on kaks optilise tassi kihti, millest üks sisaldab suurt hulka valgustundlikke rakke, mida nimetatakse fotoretseptoriteks. Kuna võrkkesta degeneratsioon tuleneb peamiselt fotoretseptorite kahjustusest, võib hESC-st pärit kude olla ideaalne siirdamismaterjal.
Jaapani teadlaste uuring mitte ainult ei ava uusi väljavaateid tüvirakkude kasutamiseks regeneratiivses meditsiinis, vaid kiirendab kindlasti ka sellise loodusteaduse valdkonna nagu arengubioloogia arengut. Katsete käigus veendusid teadlased, et inimese embrüonaalsetest tüvirakkudest moodustunud nägemisnärvikork on palju paksem kui hiire embrüonaalsetest tüvirakkudest kasvatatud. Lisaks sisaldab see nii kepikesi kui ka kolvikesi, samas kui diferentseerumist kolvikesteks täheldatakse hiire embrüonaalsete tüvirakkude kultuuris harva. See tähendab, et embrüonaalsed rakud kannavad liigispetsiifilisi juhiseid selle silmastruktuuri loomiseks.
„Meie uuring avab tee inimestele omaste silma arenguliste iseärasuste mõistmisele, mida varem oli võimatu uurida,“ ütleb professor Sasai.

See pole professor Sasai töörühma esimene suurem edu. Eelmise aasta lõpus kasvatasid teadlased hiire embrüonaalsetest tüvirakkudest funktsionaalse hüpofüüsi eessagara (adenohüpofüüsi), mis koosneb mitmest erinevat tüüpi hormoone tootvatest rakkudest. Selle töö tulemuste kohta avaldati ajakirjas Nature artikkel pealkirjaga „Funktsionaalse adenohüpofüüsi iseformeerumine kolmemõõtmelises kultuuris“.
Hüpofüüs on aju baasil asuv väike endokriinne nääre, mis toodab mitmeid olulisi hormoone. See on eriti oluline varajases arengujärgus ja selle moodustumise laboris jäljendamine aitab teadlastel embrüogeneesi paremini mõista. Hüpofüüsi kõrvalekaldeid on seostatud kasvuhäiretega, nagu gigantism ja nägemisprobleemid, sealhulgas pimedus.
See katse poleks ilma 3D-rakukultuurita võimalik olnud. Hüpofüüs on eraldi organ, kuid selle areng nõuab keemilisi signaale otse selle kohal asuvast ajupiirkonnast ehk hüpotalamusest. 3D-kultuuris suutsid teadlased samaaegselt kasvatada kahte tüüpi kudesid kõrvuti, mille tulemuseks olid tüvirakud, mis kahe nädala pärast iseorganiseerusid hüpofüüsiks.
Fluorestsentsvärvimine näitas, et kultiveeritud hüpofüüsi kude ekspresseeris sobivaid biomarkereid ja sekreteeris hüpofüüsi eessagarale iseloomulikke hormoone. Teadlased läksid sammu edasi ja testisid sünteesitud organite funktsionaalsust, siirdades need hiirtele, kellel hüpofüüs puudus. Katsed olid edukad: biotehnoloogiliselt muundatud hüpofüüsid taastasid glükokortikoidhormoonide taseme loomade veres ja kõrvaldasid käitumuslikud sümptomid, näiteks letargia. Tüvirakkudest valmistatud implanteeritud struktuuridega hiirte seisund ei paranenud, kuna nad ei olnud kokku puutunud vajalike signaalifaktoritega ja seetõttu ei muutunud funktsionaalseks hüpofüüsiks.
Professor Sasai ja tema kolleegid plaanivad katset inimese tüvirakkudega korrata ning usuvad, et see töö võtab aega vähemalt kolm aastat.


 [
[