
Kõik iLive'i sisu vaadatakse meditsiiniliselt läbi või seda kontrollitakse, et tagada võimalikult suur faktiline täpsus.
Meil on ranged allhanke juhised ja link ainult mainekate meediakanalite, akadeemiliste teadusasutuste ja võimaluse korral meditsiiniliselt vastastikuste eksperthinnangutega. Pange tähele, et sulgudes ([1], [2] jne) olevad numbrid on nende uuringute linkideks.
Kui tunnete, et mõni meie sisu on ebatäpne, aegunud või muul viisil küsitav, valige see ja vajutage Ctrl + Enter.
Teadlased on loonud "kameeleoni" ühendi ravimresistentsete ajuvähivormide raviks
Viimati vaadatud: 02.07.2025
 ">
">Yale'i ülikooli teadlaste uus uuring kirjeldab, kuidas uus keemiline ühend ründab ravimiresistentseid ajukasvajaid, kahjustamata ümbritsevaid terveid kudesid.
Ajakirjas Journal of the American Chemical Society avaldatud uuring on oluline samm niinimetatud "kameeleonühendite" väljatöötamisel, mida saaks kasutada mitmesuguste ohtlike vähivormide vastu võitlemiseks.
Glioome tekib igal aastal ligikaudu 6,6 juhul 100 000 inimese kohta ja 14-aastaseks saades 2,94 juhul 100 000 inimese kohta. Välja arvatud teiste vähivormide metastaasid, mis jõuavad kesknärvisüsteemi, moodustavad glioomid 26% kõigist ajukasvajatest (primaarsed ajukasvajad) ja 81% kõigist pahaloomulistest ajukasvajatest.
Glioblastoomiga patsiente on aastakümneid ravitud ravimiga nimega temosolomiidi. Enamikul patsientidest tekib aga temosolomiidi suhtes resistentsus aasta jooksul. Glioblastoomiga patsientide viieaastane elulemus on alla 5%.
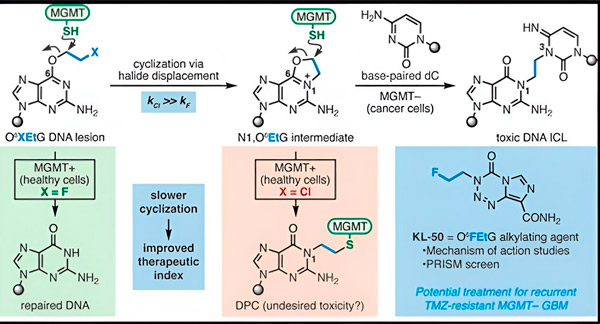
2022. aastal töötasid Yale'i keemik Seth Herzon ja kiiritusonkoloog dr Ranjit Bindra välja uue strateegia glioblastoomide tõhusamaks raviks. Nad lõid vähivastaste molekulide klassi, mida nimetatakse kameeleonühenditeks ja mis kasutavad ära DNA-d parandava valgu O6-metüülguaniini DNA metüültransferaasi (MGMT) defekti.
Paljudel vähirakkudel, sealhulgas glioblastoomidel, puudub MGMT valk. Uued kameeleoniühendid on loodud kahjustama DNA-d kasvajarakkudes, millel puudub MGMT.
Kameleoniühendid algatavad DNA kahjustusi, tekitades DNA-le primaarseid kahjustusi, mis aja jooksul arenevad väga toksilisteks sekundaarseteks kahjustusteks, mida tuntakse ahelatevaheliste ristsidemetena. MGMT kaitseb tervete kudede DNA-d, parandades primaarseid kahjustusi enne, kui need saavad areneda surmavateks ahelatevahelisteks ristsidemeteks.
Oma uues uuringus keskendusid kaasautorid Herzon ja Bindra oma juhtivale kameeleonile KL-50.
„Meie varasemate vaatluste molekulaarse aluse ja nende ühendite ainulaadse selektiivsuse tagava keemilise kineetika selgitamiseks kasutasime sünteetilise keemia ja molekulaarbioloogia uuringute kombinatsiooni,“ ütles Herzon, Yale'i ülikooli Milton Harrise keemiaprofessor. „Me näitame, et KL-50 on ainulaadne selle poolest, et see moodustab DNA-ristsidemeid ainult defektse DNA-reparatsiooniga kasvajates. See säästab terveid kudesid.“
Allikas: Ameerika Keemiaühingu ajakiri (2024). DOI: 10.1021/jacs.3c06483
See on oluline erinevus, toovad teadlased välja. Mitmed teised vähivastased ühendid on loodud ahelatevaheliste ristseoste käivitamiseks, kuid need ei ole kasvajarakkude suhtes selektiivsed, mis piirab nende kasulikkust.
Teadlaste sõnul peitub KL-50 edu saladus ajastuses. KL-50 moodustab ahelatevahelisi ristsidemeid aeglasemalt kui teised ristsidemete tekitajad. See viivitus annab tervetele rakkudele piisavalt aega MGMT kasutamiseks ristsidemete moodustumise vältimiseks.
„See ainulaadne profiil viitab selle potentsiaalile ravimiresistentse glioblastoomi ravis, mis on kliinikus suur rahuldamata vajadus,“ ütles Bindra, Yale'i Meditsiinikooli Harvey ja Kate Cushingi nimeline terapeutilise radioloogia professor. Bindra on ka Smilo haigla Cheneverti perekonna ajukasvajate keskuse teadusdirektor.
Herzon ja Bindra ütlesid, et nende uuring rõhutab keemilise DNA modifitseerimise ja biokeemilise DNA parandamise kiiruse arvestamise olulisust. Nad usuvad, et saavad seda strateegiat kasutada teiste vähivormide ravimeetodite väljatöötamiseks, mis sisaldavad spetsiifilisi kasvajaga seotud DNA parandamise defekte.
