
Kõik iLive'i sisu vaadatakse meditsiiniliselt läbi või seda kontrollitakse, et tagada võimalikult suur faktiline täpsus.
Meil on ranged allhanke juhised ja link ainult mainekate meediakanalite, akadeemiliste teadusasutuste ja võimaluse korral meditsiiniliselt vastastikuste eksperthinnangutega. Pange tähele, et sulgudes ([1], [2] jne) olevad numbrid on nende uuringute linkideks.
Kui tunnete, et mõni meie sisu on ebatäpne, aegunud või muul viisil küsitav, valige see ja vajutage Ctrl + Enter.
Uuringus rõhutatakse vajadust rakutüübispetsiifiliste ravimeetodite järele HIVi vastu.
Viimati vaadatud: 02.07.2025
Illinoisi ülikooli teadlased on näidanud HIV-i ravis spetsiifiliste rakutüüpide sihtimise olulisust. Nende uuring, mis avaldati ajakirjas Proceedings of the National Academy of Sciences, on üks esimesi, mis uurib HIV-i latentsuse modulatsiooni diferentsiaalset või rakutüübispetsiifilist mõju müeloidrakkudele, mis on luuüdis toodetav immuunrakkude tüüp.
Üks peamisi takistusi HIV-nakkuse likvideerimisel on latentsusaja ehk perioodi, mille jooksul nakatunud rakk on uinunud ega saa viirust toota, haldamine. Latentsed HIV-rakud kogunevad kehas kohtadesse, mida nimetatakse reservuaarideks. Latentsed reservuaarid on problemaatilised, kuna need võivad viirust tootma hakata igal ajal.
Haiguse täielik likvideerimine eeldaks kõigi latentsete rakkude eemaldamist organismist või püsivat vastupanu aktivatsioonistiimulitele. Taasaktiveerumist võivad aga käivitada mitmesugused tegurid, sealhulgas signaalid, mis suunavad müeloidrakkude diferentseerumist.
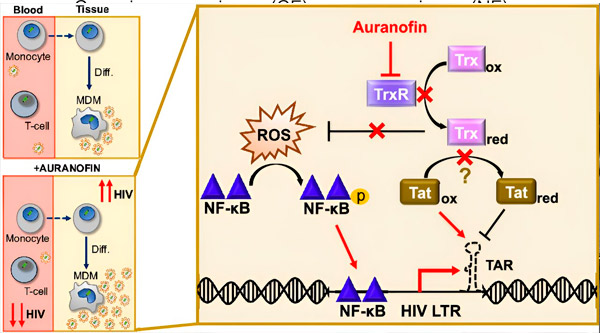
HIV latentsuse regulatsioon monotsüütidest pärinevates makrofaagides (MDM-ides) võib kujutada endast ohtu viiruse levikule. Monotsüütide diferentseerumine makrofaagideks võib vallandada HIV taasaktiveerimise, mis võib potentsiaalselt soodustada viiruse levikut kudedes (üleval vasakul). Kliiniline kandidaat, auranofiin, vähendab viiruse DNA-d veres ja soodustab HIV latentsust T-rakkudes ja monotsüütides, kuid põhjustab HIV taasaktiveerimist MDM-ides (all vasakul). MDM-ide puhul oleme hüpoteesiks seadnud, et TrxR-i pärssimine auranofiini poolt viib reaktiivsete hapnikuühendite (ROS) akumuleerumiseni, mis indutseerib NF-κB aktivatsiooni ja HIV LTR promootori aktivatsiooni (paremal). TrxR-i pärssimine vähendab potentsiaalselt substraadi redutseerimist, võimaldades Tat-valgul jääda eelistatavalt oksüdeerituks, kus see saab seonduda TAR-iga ja algatada HIV transkriptsiooni. Allikas: Proceedings of the National Academy of Sciences (2024). DOI: 10.1073/pnas.2313823121
Aastaid on HIV-i ravimise uuringud keskendunud kahele lähenemisviisile, mida tuntakse kui „šoki ja tapa“ ning „blokeeri ja lukusta“. Esimene toimib koos retroviirusevastase raviga, et aktiveerida latentselt nakatunud rakke ja tappa need apoptoosi ehk programmeeritud rakusurma kaudu, samas kui teine sunnib nakatunud rakke sügavasse latentsesse olekusse, millest nad ei saa ise taasaktiveeruda.
Nende tehnikate uuringud on traditsiooniliselt keskendunud teatud tüüpi valgelibledele, mida nimetatakse T-rakkudeks ja mis on HIV-nakkuse peamine sihtmärk. Latentsed reservuaarid koosnevad aga enamast kui ainult T-rakkudest; tegelikult sisaldavad need kümneid erinevaid rakutüüpe, millel igaühel on oma unikaalsed HIV-geeni ekspressiooni mustrid.
„Isegi ühe liini sees on rakkude mitmekesisus tohutu,“ ütles Collin Kieffer, mikrobioloogia dotsent ja artikli autor. „Reaktsiooni varieeruvus nendes reservuaarides suureneb iga uue rakutüübiga.“
Kieffri labori magistrant Alexandra Blanco tahtis uurida rakutüüpe, mis traditsioonilises HIV-uuringus olid kahe silma vahele jäänud. Keskendudes müeloidrakkudele, lõi ta klooniteegi, mis sisaldas 70 latentselt nakatunud monotsüütide populatsiooni. Seejärel analüüsis Blanco klonaalseid populatsioone ja nende reaktsioone aktiveerimisele. Reaktsioonid varieerusid suuresti, mis rõhutas suurt mitmekesisust ühe rakutüübi piires.
See tähelepanek tõstatas uue küsimuse: kas erinevatel rakutüüpidel on HIV-i latentsusfaasi ravile tõesti erinev reaktsioon? Tõepoolest, nende tulemused näitasid, et mõned HIV-i latentsusfaasi ravimeetodid võivad soodustada T-rakkude ja monotsüütide latentsust, samas kui makrofaagides võivad nad latentsust tagasi pöörata.
„Kõik keharakud ei ole ühesugused,“ ütles Kieffer. „Seega on loogiline, et kõik nakatunud rakud ei reageeri viirusele ühtemoodi.“
Nende töös rõhutatakse vajadust, et tulevaste HIV-ravimeetodite puhul arvestataks kõigi rakutüüpidega ja sellega, kuidas iga rakk võiks potentsiaalsetele ravimeetoditele reageerida.
Nende tulemused tuginevad Roy Dari, endise Illinoisi bioinseneri professori uuringutele, kelle laboris uuriti HIV-geeni ekspressiooni heterogeensust.
„Tema alustas ja meie võtsime selle üle ning ehitasime selle sinna, kus see täna on,“ ütles Kieffer. „Seega andis koostöö neile tulemustele tõelise tõuke. See on meie laborile uue suuna andnud ja me oleme selle üle väga põnevil.“
Blanco analüüsi täiendav ja ootamatu leid näitas muutusi rakkude suuruses ja kujus vastusena infektsioonile, mis viitab sellele, et HIV võib muuta rakkude morfoloogiat. Blanco järgmine eesmärk on tuvastada nende fenotüüpiliste muutuste aluseks olevad bioloogilised mehhanismid.
Kieffer ja tema labori liikmed ootavad põnevusega ka oma tulemuste, mis enamasti saadi rakuliinil, korramist primaarsetes rakkudes. Tulemuste korramine inimlikumas mudelis parandaks uuringu kliinilist olulisust, selgitas Kieffer.
„Me tahaksime teha suuremaid uuringuid T-rakkudes, monotsüütides ja makrofaagides, et tuvastada potentsiaalseid ravimeid, mis võiksid toimida kõigile neile rakutüüpidele,“ ütles Blanco. „Võime leida veelgi rohkem molekule, mis ei käitu rakutüübispetsiifiliselt.“
