
Kõik iLive'i sisu vaadatakse meditsiiniliselt läbi või seda kontrollitakse, et tagada võimalikult suur faktiline täpsus.
Meil on ranged allhanke juhised ja link ainult mainekate meediakanalite, akadeemiliste teadusasutuste ja võimaluse korral meditsiiniliselt vastastikuste eksperthinnangutega. Pange tähele, et sulgudes ([1], [2] jne) olevad numbrid on nende uuringute linkideks.
Kui tunnete, et mõni meie sisu on ebatäpne, aegunud või muul viisil küsitav, valige see ja vajutage Ctrl + Enter.
Talidomiidi ühendite derivaadid põhjustavad resistentsete vähirakkude surma
Viimati vaadatud: 02.07.2025
 ">
">Frankfurdi Goethe ülikooli uuring viitab võimalusele, et talidomiidi derivaate võiks potentsiaalselt kasutada vähi raviks. Talidomiidi müüdi 1950. aastatel unerohuna. Hiljem sai see kurikuulsaks raskete sünnidefektide põhjustamise poolest raseduse algstaadiumis.
Molekul on teadaolevalt ka võime märgistada raku valke hävitamiseks. Praeguse uuringu osana lõid teadlased talidomiidi derivaate. Nad suutsid näidata, et need ained mõjutavad vähirakkude ellujäämise eest vastutavate valkude hävitamist.
Võib-olla pole ühelgi teisel molekulil olnud nii tormilist minevikku kui talidomiidil. See oli peamine koostisosa ravimis, mis kiideti 1950. aastatel paljudes riikides heaks rahustava ja unerohuna. Kuid peagi selgus, et talidomiidi võtnud rasedad naised sünnitasid sageli tõsiste väärarengutega lapsi.
Viimastel aastakümnetel on meditsiin sellele aga taas suuri lootusi pannud. Uuringud on muuhulgas näidanud, et see pärsib veresoonte kasvu ja on seetõttu potentsiaalselt sobiv kasvajate eraldamiseks toitainekeskkonnast. Seejärel osutus see väga tõhusaks ka hulgimüeloomi ehk luuüdi pahaloomuliste kasvajate ravis.
„Nüüd teame, et talidomiidi võib nimetada molekulaarseks liimiks,“ selgitab dr Xinglai Cheng Frankfurdi Goethe ülikooli farmatseutilise keemia instituudist. „See tähendab, et see suudab haarata kaks valku ja need kokku ühendada.“
See on eriti huvitav, sest üks neist valkudest on omamoodi "märgistusmasin": see kinnitab teisele valgule üheselt mõistetava "Prügi" märgistuse.
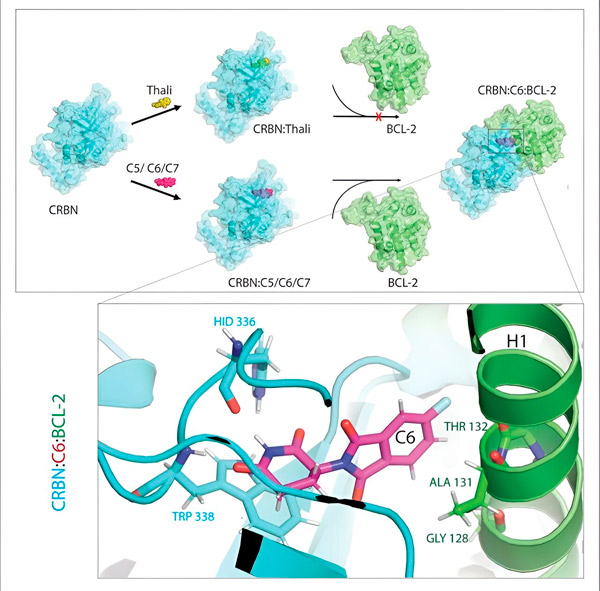
Talidomiidi derivaadid C5, C6 ja C7 muudavad CRBN-i ehk „märgistamismasinat“ nii, et see saab seonduda BCL-2-ga. Sel viisil märgistatakse BCL-2 molekul lagundamiseks – see on võimalik uus strateegia vähi vastu võitlemiseks. Autor: dr Xinglai Cheng.
Raku jääkainete kõrvaldamise süsteem tunneb selle märgise ära: see haarab märgistatud valgumolekuli ja purustab selle. „See mehhanism selgitab talidomiidi erinevaid toimeid,“ ütleb Cheng. „Sõltuvalt sellest, milline valk on märgistatud, võib see põhjustada embrüonaalse arengu ajal deformatsioone või hävitada pahaloomulisi rakke.“
See mehhanism avab meditsiinile suurepäraseid võimalusi, kuna vähirakud sõltuvad ellujäämiseks teatud valkudest. Kui neid saaks süstemaatiliselt sihtida ja purustada, saaks haiguse ehk ravida. Probleem on selles, et molekulaarne liim on üsna omapärane.
Üks selle sidumispartneritest on alati raku märgistusmasin ehk teaduskeeles E3 ligaas nimega CRBN. Teiseks partneriks saab olla vaid väga vähestest tuhandetest kehas leiduvatest valkudest – millised neist, sõltub liimist.
„Seega lõime seeria talidomiidi derivaate,“ ütleb Cheng. „Seejärel testisime, kas neil on adhesiooniomadused ja kui on, siis milliste valkude vastu need tõhusad on.“ Selleks lisasid teadlased oma derivaate kõigile kultiveeritud rakuliini valkudele. Seejärel jälgisid nad, millised neist valkudest CRBN-i juuresolekul lagunesid.
„Selle käigus tuvastasime kolm derivaati, mis võiksid märgistada lagundamiseks väga olulist rakuvalku BCL-2,“ selgitab Cheng. „BCL-2 takistab rakkudel oma enesehävitusprogrammi aktiveerimast, seega kui seda pole, siis rakud surevad.“
Seepärast on BCL-2 pikka aega olnud vähiuuringute fookuses. On isegi olemas leukeemiaravim nimega venetoclaks, mis vähendab BCL-2 efektiivsust ja põhjustab seeläbi muteerunud rakkude enesehävitust.
„Kuid paljudes vähirakkudes on BCL-2 ise muteerunud. Selle tulemusena ei inhibeeri venetoklaks enam valku,“ ütleb Cheng. „Suutsime näidata, et meie derivaadid märgistavad ka selle muteerunud vormi lagunemiseks. Lisaks simuleerisid meie partnerid Max Plancki Biofüüsika Instituudis arvuti abil talidomiidi derivaatide interaktsiooni BCL-2-ga. See näitas, et derivaadid seonduvad täiesti erinevate saitidega kui venetoklaks – tulemus, mida saime hiljem eksperimentaalselt kinnitada.“
Teadlased testisid oma ühendeid ka vähirakkudega äädikakärbeste peal. Sel viisil töödeldud kärbeste ellujäämismäär oli oluliselt kõrgem. Cheng hoiatab aga liialt suurte lootuste eest, kuna need tulemused on endiselt baasuuring. "Kuigi need näitavad, et modifitseeritud talidomiidi molekulidel on suur terapeutiline potentsiaal, ei saa me veel öelda, kas need mingil ajahetkel praktikas tõestavad end."
Uuringu tulemused avaldati ajakirjas Cell Reports Physical Science.
